
Ein Großteil des globalen Energiebedarfs wird heute durch fossilen Brennstoffen abgedeckt. Gleichzeitig sagt die Internationale Energieagentur voraus, daß sich der weltweite Energiebedarf bis 2040 verdoppeln wird. Dies ist hauptsächlich durch den zusätzlichen Bedarf in Schwellen- und Entwicklungsländern begründet.
Um den wachsenden globalen Energiebedarf zu bedienen und fossile Brennstoffe zu ersetzen, hat sich bei politischen Entscheidungsträgern die Meinung durchgesetzt, daß alternative, saubere und erneuerbare Energiequellen die beste Lösung sind. Solche erneuerbaren Energiequellen können Strom aus Solar-, Windenergie oder Geothermie sowie Wasserkraft sein. Fuer letztgenannte stehen jedoch keine zusätzlichen Standorte in Industrieländern zur Verfügung.
Während Sonnen- und Windenergie an den meisten Orten der Welt zu mehr oder weniger angemessenen Kosten verfügbar sind, ist ihr größter Nachteil, daß sie instet verfuegbar, schwer zu lagern und zu transportieren sind. Außerdem kann man damit keine Autos, Flugzeuge oder Schiffen betanken. Die Umwandlung von Sonnen- und Windenergie in Wasserstoffgas könnte ein eleganter Weg aus diesem Dilemma sein. Der Rohstoff Wasser stünde reichlich zur Verfügung. Die Diversifizierung des Energiemixes durch Hinzufügen von Wasserstoff zu erschwinglichen Kosten kann mit geringeren Emissionen zudem effizienter sein. Daher wächst das Interesse an Elektrolyse und Brennstoffzellen stetig.
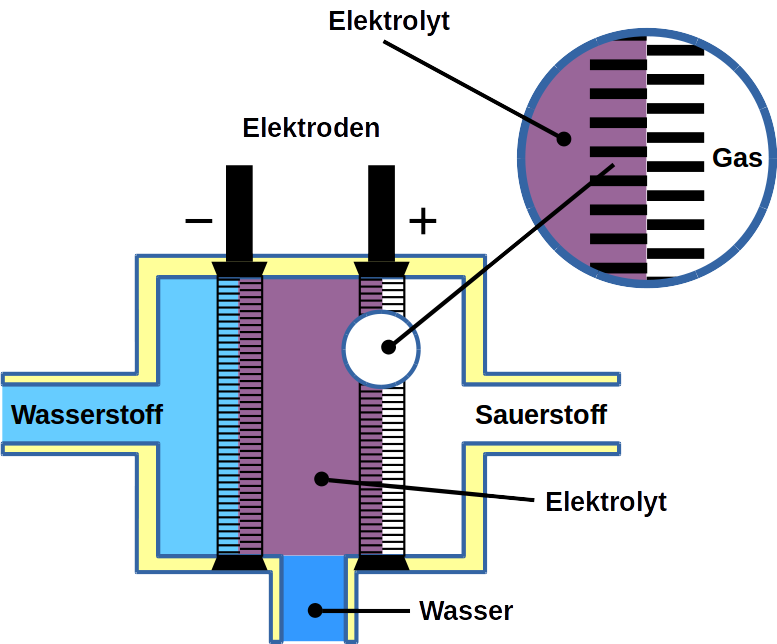
Der gößte Anteil des heute verbrauchten Wasserstoffs wird durch Dampfreformierung von Erdgas hergestellt. Wasserstoff kann jedoch auch durch Elektrolyse von Wasser gewonnen werden. Elektrolyse erfolgt in zwei Elektrodenreaktionen: Der Wasserstoffreaktion (WR) an der Kathode und der Sauerstoffreaktion (OR) an der Anode.
Brennstoffzellen kehren die Elektrolysereaktionen um indem sie Wasserstoff und Sauerstoff wieder zusammenfügen, um Wasser zu erhalten. Damei wird elektrische Energie freigesetzt. Während es verschiedene Arten von Brennstoffzellen gibt, werden diejenigen, die üblicherweise mit Wasserstoff als Brennstoff verwendet werden, als Polymerelektrolytmembran-Brennstoffzellen oder PEMFC bezeichnet. Die PEM-Abkürzung wird auch häufig für Protonenaustauschermembranen verwendet, die aus Polymeren hergestellt werden können, beispielsweise Nafion™. In PEMFC wird die Energie durch die Wasserstoffoxidationsreaktion (WOR) an der Anode- und Sauerstoffreduktionsreaktion (ORR) an der Kathode freigesetzt. Um wirtschaftlich machbar zu werden, gibt es noch technische Herausforderungen von Wasserelektrolyzern und Brennstoffzellen, um zu überwinden. Einige technische Probleme führen zu einem ernsthaften Systemabbau.

Eine Studie, die Forscher der Technischen Universität Berlin und des Korea Institute of Science and Technology in Nature Communications veröffentlicht wurde, schlägt einen neuartigen Iridium-Elektrokatalysator mit multifunktionalen Eigenschaften und bemerkenswerter Reversibilität vor. Zwar ist Iridium ebenfalls ein Edelmetall der Platin-Gruppe-Metalle. Der neuartige Iridium-Katalysator wurde jedoch für die Prozesse ausgelegt, in denen sich elektrochemische Reaktionen schnell ändern, wie beispielsweise die Spannungsumkehr der Wasserelektrolyse- und PEMFC-Systeme. Dies würde die beiden Systeme in einem vereinen und somit ein großer wirtschaftlicher Nutzen gegenüber bestehenden Lösungen sein.
Bestehende Herausforderungen
Überraschend sich ändernde Betriebsbedingungen wie zum Beispiel das plötzliche Abschalten der Elektrolysespannung führen zu erhöhten Wasserstoffelektrodenpotentialen. Das führt wiederum zum Zerfall der Wasserstoff produzierenden Elektroden.
In Brennstoffzellen kann an der Anode die Kraftstoffmangel auftreten, was zu einer Spannungsumkehr führt. Letztendlich bewirkt dies die Ermüdung der Brennstoffzellenkomponenten wie zum Beispiel des Katalysatorträgers, der Gasdiffusionsschicht und Flußfeldplatten. Um einen beständigen Wasseroxidationskatalysator an die Anode der PEMFCs einzuführen, um die Sauerstoffreaktion zu beschleunigen. Die Wasseroxidation konkurriert letztlich mit der Kohlenstoffkorrosion als Elektronenquelle.
Gestaltung eines einzigartigen multifunktionalen iridiumbasierten multifunktionalen Katalysators
Für die Studie wurde ein kristalliner multifunktionaler Iridium-Nanokatalysator unter Berücksichtigung der genannten Herausforderungen für Elektrolyse und Brennstoffzellen entworfen.
Der Grund, washalb ein Material basierend auf Iridium ausgewählt wurde, ist bemerkenswerte Katalyseaktivität der Sauerstoffreaktion bei gleichzeitig guter Wasserstoffbildung und -oxidation. Es ist ein hervorragendes Material für Anoden und Kathoden in Elektrolyseuren sowie für Brennstoffzellen-Anoden. Um eine Referenz fuer ihren IrNi-Nanopartikel auf Kohlenstoff mit hoher Kristallinität (IrNi/C-HT) zu haben, synthtisierten die Wissenschaftler eine Variante mit niedriger Kristallinität (IrNr/C-LT). Dabei wurde ein spezielles Imprägnierverfahren verwendet.
Die Forscher zeigten, daß die Oberfläche von IrNi/C-HT reversibel zwischen dem metallischen und mineralischen IrNiOx-Zustand umgewandelt wurde. Bei Sauerstoffentwicklung, das heißt bei anodische Wasseroxidation, bildeten die kristallinen Nanopartikel eine dünne IrNiOx-Atomschicht. Diese Oxidschicht verwandelte sich reversibel in metallisches Iridium, wenn sie auf kathodische Potentiale zurückkehrt. Die Umkehrung ermöglicht es dem Katalysator, seine hohe Wasserstoff-Redox-Aktivität wiederzuerlangen.
Die Experimente zeigten auch, daß die Leistung von IrNi/C-LT nach der Sauerstoffbildung stark abnimmt. Der Katalysatorabbau war auf die irreversible Zerstörung der amorphen IrNiOx-Oberfläche zurückzuführen.
In situ-Aufnahmen mithilfe der XANES-Spektroskopie und der Röntgenphotoelektronenspektroskopie (XPS) an der dünnen IrNiOx-Schicht bestätigten eine Zunahme der d-Bandlöcher während Sauerstoffreaktion. Diese wurden fuer die hervorragende Wasseroxidationseigenschaften IrNi/C-HT-Katalysators verantwortlich gemacht. Die dünne IrNiOx-Schicht wurde wie erwartet reversibel in die metallische Oberfläche umgewandelt. Die mechanistische Untersuchung der reversiblen katalytischen Aktivität der IrNiOx-Schicht der Brennstoffzelle wurde elektrochemisch und durch Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS) untersucht. Auch hier wurde gezeigt, daß die reversiblen IrNiOx-Schichten regeneriert wurden.
Darüber hinaus wurden die Leistung und katalytische Umkehrbarkeit synthetisierter Elektrokatalysatoren getestet. Die Wasserstoffoxidation und Sauerstoffbildung wurden in einer Brennstoffzelle unter Kraftstoffmangel untersucht. Unter Verwendung der Spannungsumkehrung wurde die Brennstoffzelle in einen Elektrolyseur umgewandelt.
Kraftstoffmangel wurde in einer PEM-Brennstoffzelle mit IrNi/C-HT und IrNi/C-LT herbeigeführt. Die anfängliche Brennstoffzellenleistung von IrNi/C-LT und -HT war jedoch aufgrund der auftrtenden Wasserstoffoxidation und der speziellen Metallzusammensetzung niedriger als der des kommerziellen Pt/C-Katalysators.
Es wurde außerdem gezeigt, daß der IrNi/C-HT-Katalysator seine bifunktionelle katalytische Aktivität in der Brennstoffzelle / dem Elektrolyseur beibehielt. Der neue Ansatz soll nun zukünftige Forscher ermuntern, ebenfalls die Umkehrbarkeit von Nanokatalysatoren untersuchen. Eine Vielzahl von elektrochemischen Reaktionen werden so ermöglicht, angefangen mit der Spannungsumkehr in Brennstoffzellen und Elektrolyseuren.
Bei Frontis Energy freuen wir uns auf den neuen Iridium-Katalysator in unserem Shop, sobald dieser verfügbar ist.
Foto: Iridium / Wikipedia








Sie müssen angemeldet sein, um einen Kommentar zu veröffentlichen.